uLAB
z Ceramiką na Ty ...
Nie jesteś zalogowany na forum.
- Wątki: Aktywne | Bez odpowiedzi
Strony: 1
#1 2021-10-27 02:08:23
- urs
- Administrator
- Dołączył: 2021-10-24
- Liczba postów: 248


biały zwój mózgu w formule
... aj, podręczę was obliczeniami, podręczę; z nadzieją, że nie zadręczę ... - biały zwój mózgu raz jeszcze (kamionkowo, rzecz oczywista)
- biały zwój mózgu raz jeszcze (kamionkowo, rzecz oczywista)
w pracowni trafiłam na bardzo ciekawe poszukiwania wokół tego szkliwa, tym razem przedstawionego w formule. jako ''niewierny Tomasz'' doświadczenie powtórzę, rezultaty będą przybywać w czasie. celem jest zbadanie zbiegnięć, czy też białych zwojów, naszego ''mózgu''. zmiennymi wartościami są krzemionka i tlenek glinu; stałymi, zestaw związków zasadowych, czyli topników.
podobno przy korekcji szkliwa należy najpierw zająć się proporcją pomiędzy krzemionką a tlenkiem glinu. zmiana bazy, czyli topników, może zbytnio zmienić charakter szkliwa, zbyt wiele zmiennych nie pozwoli nam przebadać czegokolwiek.
a zatem zaczynamy...
szkliwo magnezowe w zwojach - wartości w molach
proponowana baza topników sprowadzonych do jedności:
CaO 0.15 │ KNaO 0.15 │ MgO 0.7
[btable]
[mrow] SiO2
[row] 1.5
[row] 1.0
[row] [col] 0.15 [col] 0.20 [col] 0.25 [col] 0.30 [col] 0.35 [col] 0.40 [col] 0.45 [col] 0.50 [col] 0.55 [mcol] Al2O3
[/btable]
... z czasem tabelę wypełnią obrazki ![[dblpt]mrgreen[dblpt]](http://www.ulab.oxn.pl/upload/oxn_pl/ulab/smilies/[dblpt]mrgreen[dblpt].gif)
ale jest już gotowy test. nazwiska autora niestety na razie nie znam (uzupełnię)... jest nim prof akademii w Charleroi specjalizującej się w nauce o szkliwach, jedyna chyba tego typu szkoła w belgii.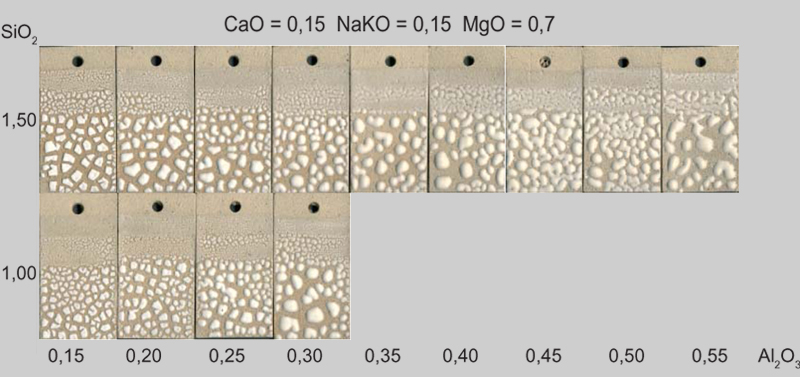
... czekając na rezultaty przyjżyjmy sie z bliska ''white brain''s crawl'', czyli sprowadźmy go do formuły i porównajmy z podanymi powyżej próbkami...
skład szkliwa:
- sjenit nefelinowy 70
- węglan magnezu 30
inne potrzebne informacje:
■ dla sjenitu nefelinowego:
uproszczony ze względów praktycznych wzór teoretyczny:
1 KNaO │ 1 Al2O3 │ 4.5 SiO2 │ cM:442
(jak widać różny od znanego już nam: K2O.3Na2O.4Al2O3.8SiO2). alkalia (K2O i Na2O) sprowadzone są do jedności, a ilość krzemionki bardziej przypomina rzeczywistą jej ilość w dostępnych surowcach.
■ dla węglanu magnezu:
MgCO3 │ cM:84 [84=24+12+3x16] -> 1 MgO
i tak:
70 (np. g) sjenitu nefelinowego dzielimy przez jego ciężar molowy. dowiemy się wtedy ile moli tego związku znajduje się w szkliwie (proporcjonalnie oczywiście)
70 / 442 = 0.1583
30 (g) węglanu magnezu przez jego ciężar molowy 84
30 / 84 = 0.3571
kolejnym krokiem jest sporządzenie tabeli ze wszystkimi tlenkami, które znajdą swoje miejsce w szkliwie po wypale (od zasadowych poprzez amfoteryczne do kwaśnych) i zanotowanie w odpowiednich rubrykach wartości molowych
[btable]
[mrow][mcol] KNaO [mcol] MgO [mcol] Al2O3 [mcol] SiO2
[row][col] 1 x 0.1583 [col] 1 x 0.3571 [col] 1 x 0.1583 [col] 4.5 x 0.1583 = 0.7126
[row]
[row][col] 0.3071 [col] 0.6928 [col] 0.3071 [col] 1.3826 [/btable]
wg zasad formuły sprowadzamy związki tzw. zasadowe do jedności. aby to uzyskać sumujemy ich wartości:
0.1583 + 0.3571 = 0.5154 -> 0.5154/0.5154=1
po czym wartość każdego z tlenków dzielimy przez tą sumę i zapisujemy obliczenia w tabeli
0.1583/0.5154=0.3071
0.3571/0.5154=0.6928
0.1583/0.5154=0.3071
0.7126/0.5154= 1.3826
formuła naszego szkliwa to:
0.30 KNaO │ 0.69 MgO │ 0.30 Al2O3 │ 1.38 SiO2
porównując z podanymi próbkami wiemy już gdzie jesteśmy ... :wink:
Offline
Strony: 1
- Użytkowników czytających ten temat: 0, gości: 1
- [Bot] ClaudeBot